Sulfooxidace alkanů
Řešená cvičení
Zatím zde nejsou žádné řešené příklady
Testy
-%
Sulfooxidace alkanů
Střední škola • 2 min
-%
Produkty sulfooxidace -%
Podrobnosti o látce
Výpisky ke stažení
Autor videa
Jan Blahut
Lektor chemie, fyziky, matematiky a českého jazyka.
Klíčová slova
Střední škola
Odhadovaná délka studia
0 h 9 min
Poznámka k videu
Poslední reakcí, probíhající mechanismem radikálové substituce (\(S_R\)), je sulfoxidace alkanů. Již z názvu je patrné, že se jedná o oxidaci spojenou se sulfonací (= proces zavádění skupiny \(SO_3H\) do molekuly; mechanismus podobný sulfochloraci). Při sulfoxidaci nahrazuje molekula kyslíku oxid siřičitý a v praxi se obvykle používá přímo směsi oxidu siřičitého, sírového a kyslíku, která se uvádí do uhlovodíku v přítomnosti iniciátoru (například dibenzoylperoxid).
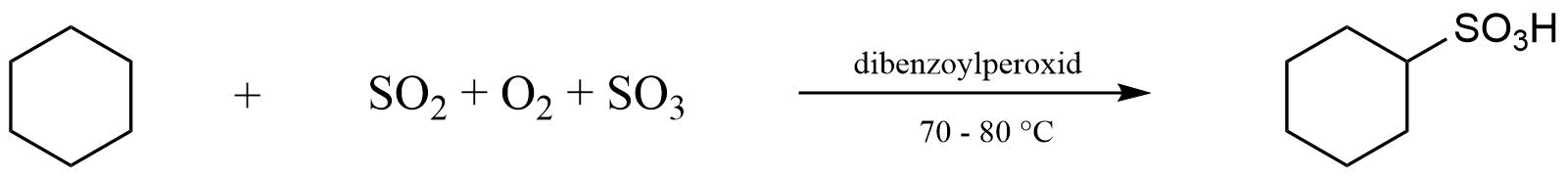
Obr. 1: Příklad sulfoxidace cykloalkanu
Jak je uvedeno výše, mechanismem sulfoxidace je \(S_R\). Z předchozích tematických celků již víme, že tento reakční mechanismus probíhá pomocí několika fází. Jmenovitě to jsou iniciace, propagace a terminace. Nutno podotknout, že následující schéma je pouze orientační, poněvadž ve směsi vzniká nepřeberné množství produktů. Radikály jsou velice reaktivní molekuly a neselektivně se vážou v reakční směsi.
Ad peroxid: Vznik radikálů za zvýšené teploty (termolýza)
Jsou to sloučeniny, které poskytují radikály za mírných reakčních podmínek (při teplotách pod 200 °C), např. dibenzoylperoxid, azobis(isobutyronitril) zkráceně AIBN při 60-80 °C. Takovéto sloučeniny se často používají jako iniciátory radikálových reakcí.
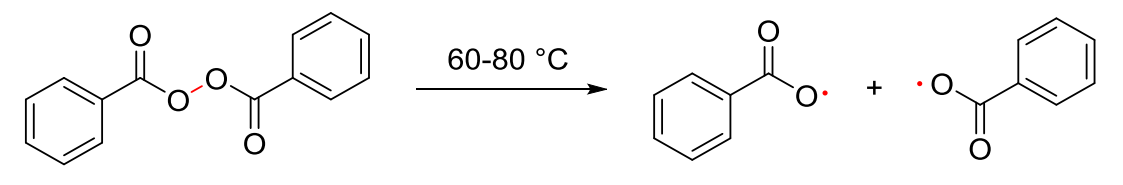
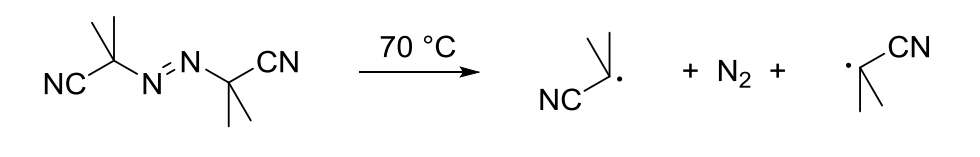
Obr. 2: Termolýza labilních vazeb a vznik radikálů.
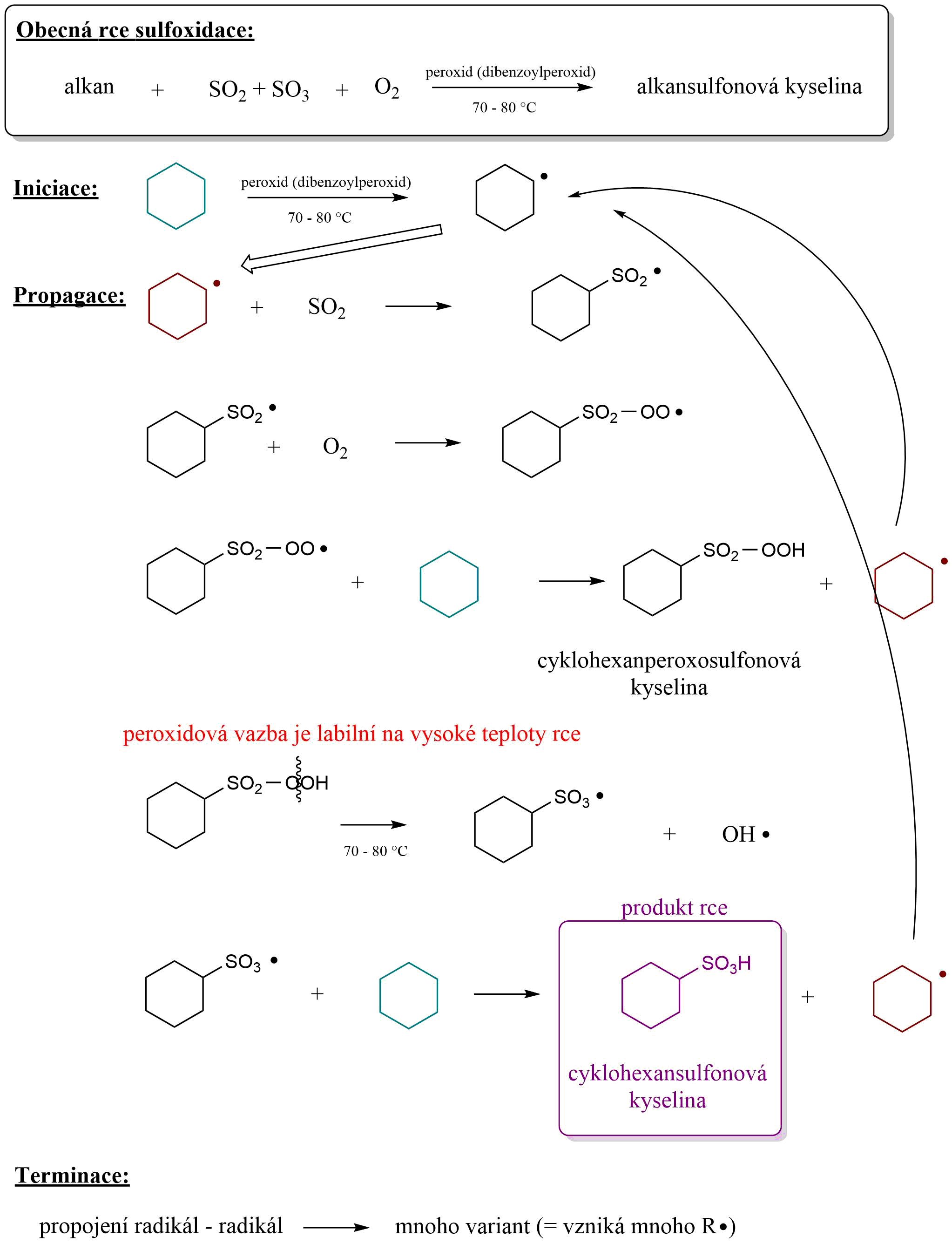
Obr. 3: Celkové schéma sulfoxidace cyklohexanu, při které vzniká cyklohexansulfonová kyselina.