Hydrogenace alkenů (redukce vodíkem)
Řešená cvičení
Produkty reakcí
Střední škola • 3 min
Doplňte produkty následujících reakcí:
(vizte rovnice ve videu)
Testy
-%
Hydrogenace alkenů
Střední škola • 2 min
-%
Produkt hydrogenace -%
Podrobnosti o látce
Autor videa
Jan Blahut
Lektor chemie, fyziky, matematiky a českého jazyka.
Klíčová slova
Střední škola
Odhadovaná délka studia
0 h 15 min
Poznámka k videu
Alkeny
Alkeny jsou nenasycené acyklické uhlovodíky lišící se od alkanů přítomností dvojné vazby. Výskyt dvojné vazby způsobuje mnohem větší reaktivitu oproti alkanům! Jedná se o reakční místo, které lze podrobit mnoha různým reakcím, jenž si popíšeme v následujících lekcích. Nejjednodušších alken je ethen (triviálním názvem: ethylen).
Přítomnost dvojné vazby je zásadní pro jejich reaktivitu, ale i pro jejich tvar a neschopnost konformace! Dvojná vazba je tvořena vazbou σ (sigma) a π (pí) a nelze s ní rotovat, poněvadž by došlo k přerušení překryvu π orbitalů. V tomto místě vzniká centrum, kde můžeme pozorovat cis/trans isomerii [dnes spíše preferováno E/Z = entgegen(proti)/zusammen(spolu)].
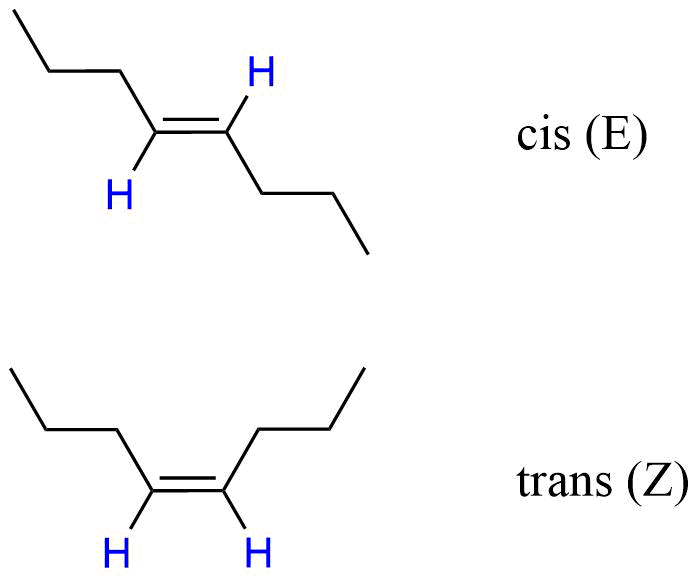
Obr. 1: Ukázka cis/trans isomerie (geometrická isomerie)
Uhlíkové atomy, ze kterých vychází dvojná vazba, jsou v hybridním stavu \(sp^2\) a jsou uspořádány v rovině. \(sp^2\) hybridizace se od \(sp^3\) liší svíranými úhly (109° u sp3 a 120° u \(sp^2\)). Jednoduše si lze představit, že v místě dvojné vazby se molekula „zplanarizuje“. Současně se zkracuje vzdálenost mezi oběma jádry a zvyšuje disociační energie vazby (pevnější vazba).
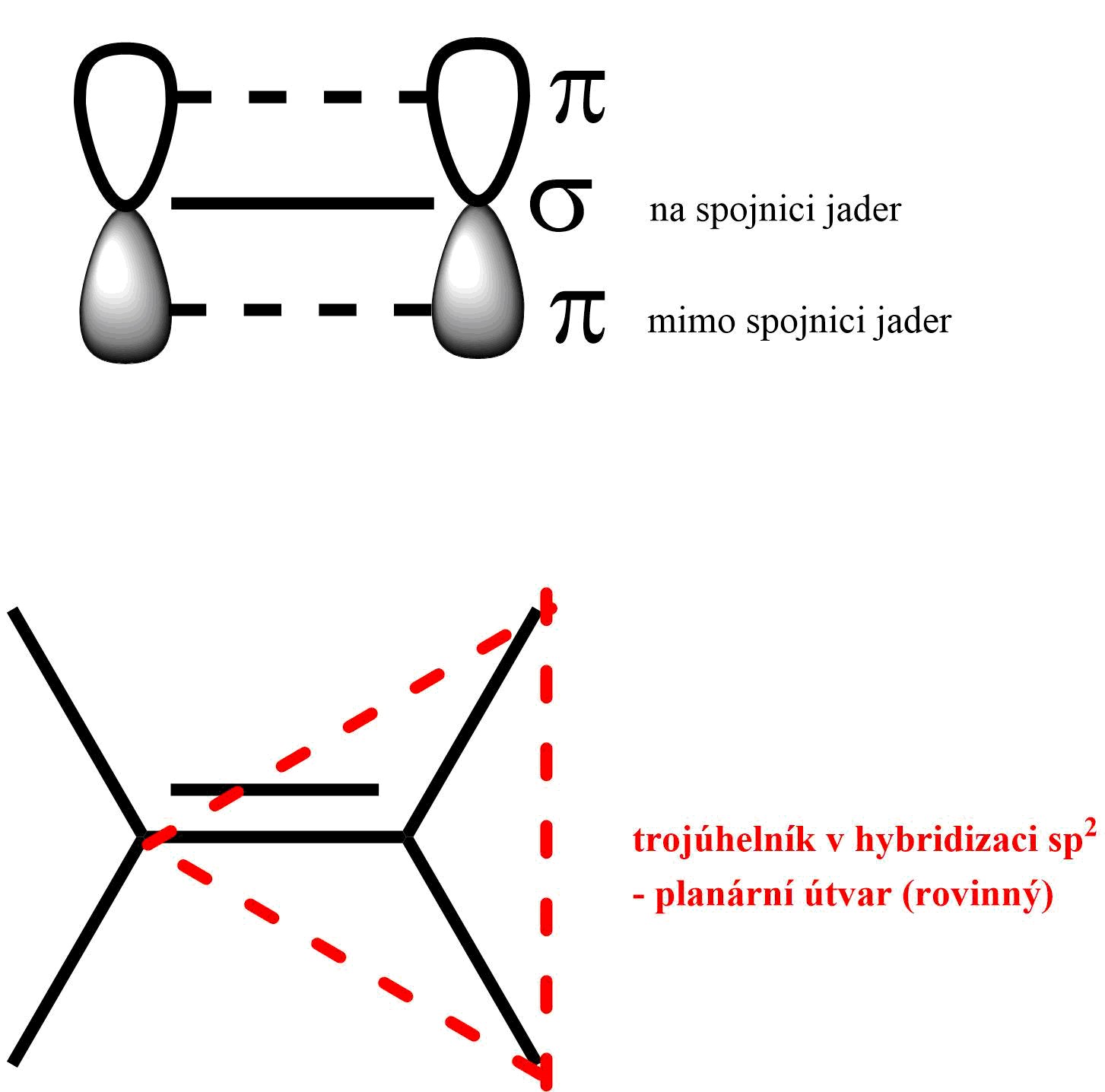
Obr. 2: Dvojná vazba znázorněná pomocí p-orbitalů [nahoře] a dopad hybridizace na rozložení molekuly ve dvojné vazbě (planární místo v molekule) [dole]
Z chemického a reakčního hlediska je přítomnost dvojné vazby (reakční centrum) velmi důležitá. Dvojná vazba do molekuly přináší π elektrony, které se nacházejí pod a nad vazbou σ (viz obr. 2) a jsou pohyblivější než elektrony mezi spojnicemi jader (σ-elektrony). Tato skutečnost, kdy π elektrony jsou více vystaveny do okolí, napomáhá k vyšší reaktivitě! Typickými reakcemi nenasycených uhlovodíků jsou adice. Jak evokuje název rce, jedná se o přidání (add) molekul, kdy dvojná vazba mezi atomy uhlíku zaniká a na každý atom se váže jedna část molekul(y). Adice může probíhat mechanismem iontovým nebo radikálovým. Dalšími rcemi alkenů jsou redox rce, polymerizace či substituce.
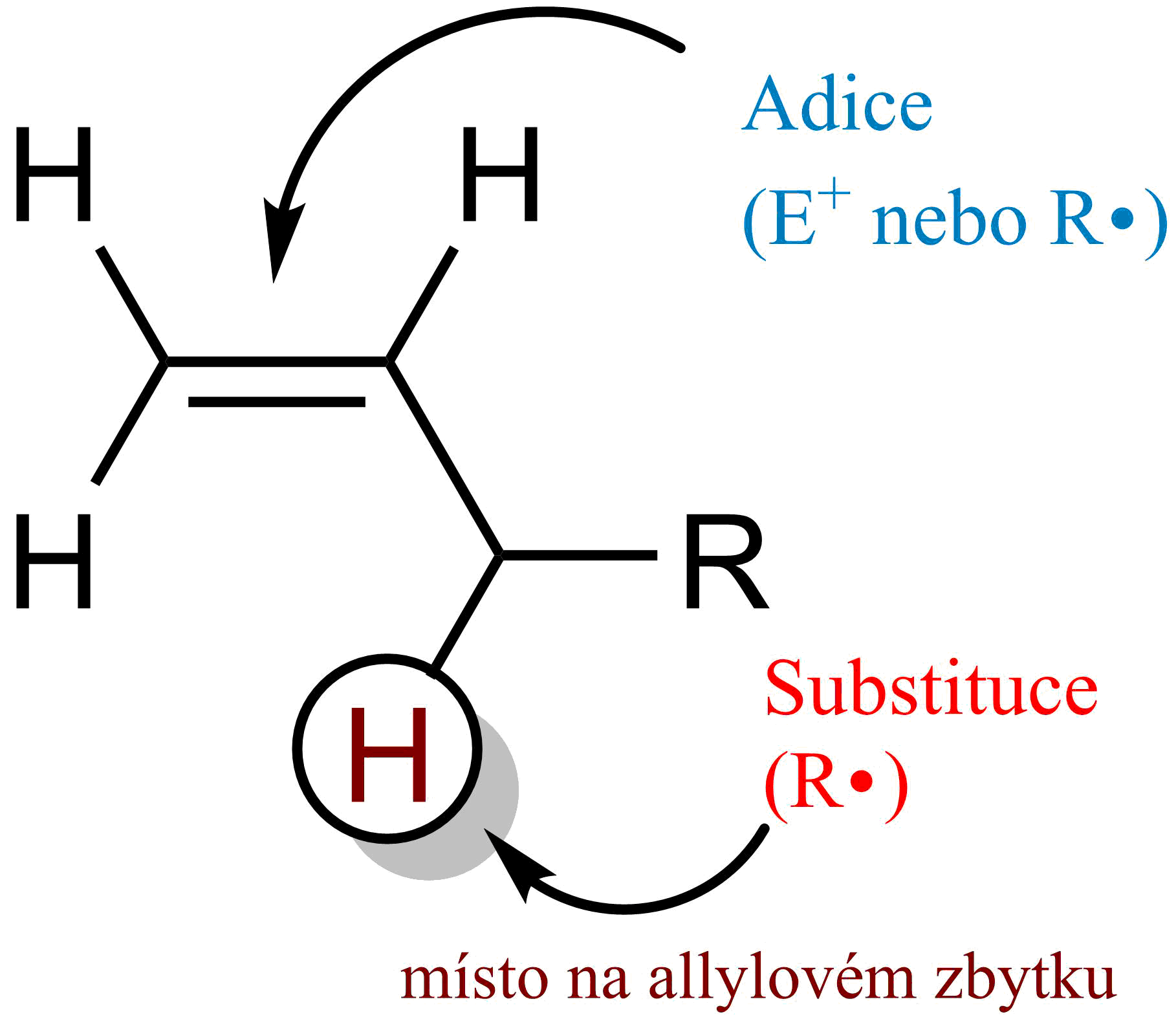
Obr. 3: Reakční místa ve struktuře alkenu.
Hydrogenace alkanů
Jedná se o redukční rci, kdy je adován vodík na dvojnou vazbu v přítomnosti hydrogenačního katalyzátoru (rce probíhá na povrchu kovového katalyzátoru; např: Ni, Pd, Pt). Za mechanismus je považována radikálová adice (\(A_R\)). Hydrogenace alkenů vede k nasycení dvojné vazby za vzniku alkanů. Poněvadž rce probíhá na povrchu katalyzátoru, alken se k němu přibližuje z jedné strany a probíhá tzv. cis adice. Oba vodíky jsou připojeny z jedné strany.
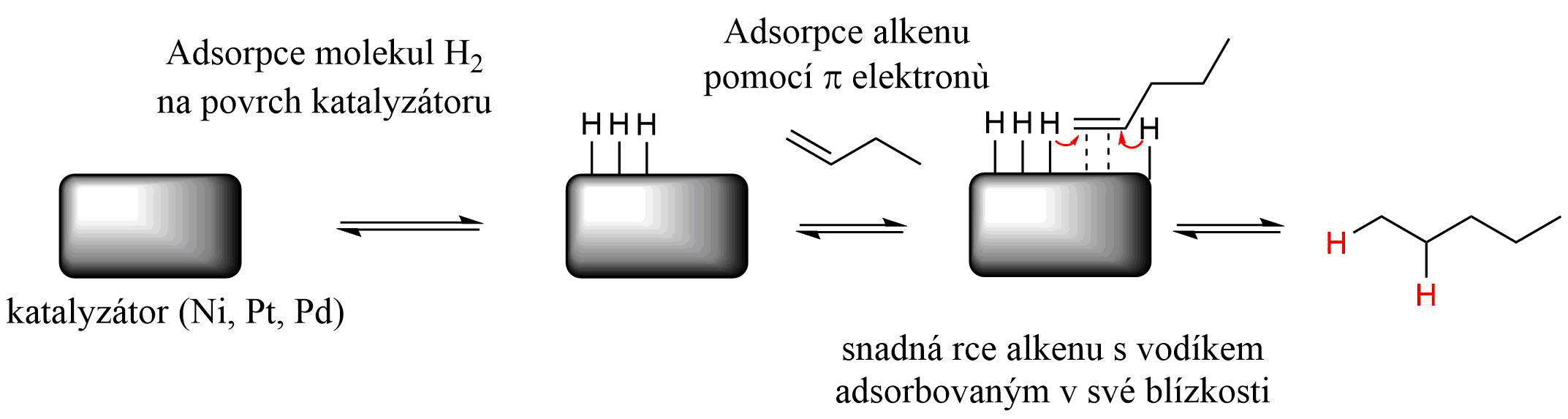
Obr. 4: Schéma mechanismu a fnce katalyzátoru.