Halogenace alkenů (adice halogenu)
Řešená cvičení
Reaktanty sloučenin
Střední škola • 6 min
Doplňte reaktanty na přípravu následujících sloučenin:
1,2-DIBROM-3-METHYLBUTAN
1,2,3,4-TETRACHLORCYKLOMEXAN
Produkt reakce
Střední škola • 6 min
Jaký bude produkt následující reakce? Zakreslete prostorovou strukturu (vizte obrázek ve videu).
Reakce propenu
Střední škola • 6 min
Propen reaguje s NBS ve volném prostředí DMSO za vzniku 1-CHLORPROPAN-2-OLU. Běží reakce dle markovníka?
Testy
-%
Halogenace alkenů
Střední škola • 2 min
-%
Hnací síla -%
Podrobnosti o látce
Výpisky ke stažení
Autor videa
Jan Blahut
Lektor chemie, fyziky, matematiky a českého jazyka.
Klíčová slova
Střední škola
Odhadovaná délka studia
0 h 40 min
Poznámka k videu
Pokud hovoříme o halogenaci alkenů, jedná se o elektrofilní adici (\(A_E^+\)). Díky vlastnostem dvojné vazby mezi dvěma uhlíky alkenu se jedná o elektronově bohatý systém. Proto může být dvojná vazba (místo vysoké hustoty elektronů) „napadena“ elektrofilem, tedy částicí s kladným nábojem, či elektronovou mezerou.
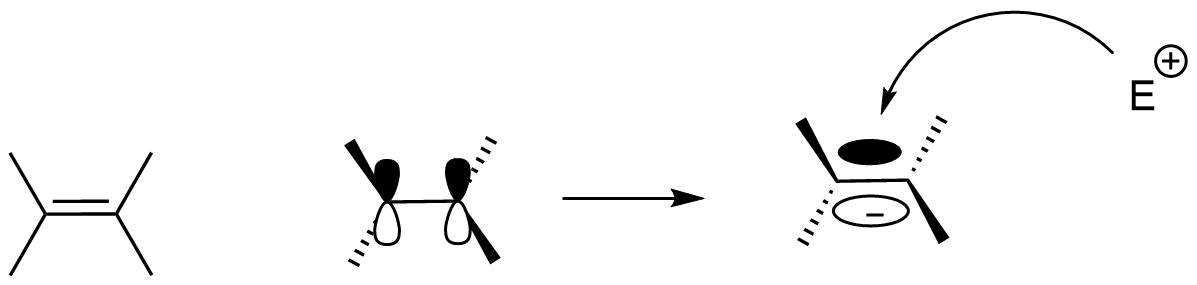
Obr. 1: Schéma elektrofilní adice na alkenu
Při halogenaci dochází k rci alkenu s halogenem za přítomnosti Lewisových kyselin (\(AlCl_3\), \(FeCl_3\)…). Lewisova kyselina je v rci velice důležitá, jelikož způsobuje rozštěpení silně nepolární vazby halogenu na elektrofil (\(E^+\)) a nukleofil (\(Nu^-\)). Lze také polarizovat molekulu halogenu polárním aprotickým (chloroform) nebo protickým rozpouštědlem (voda, alkoholy, organické kyseliny).
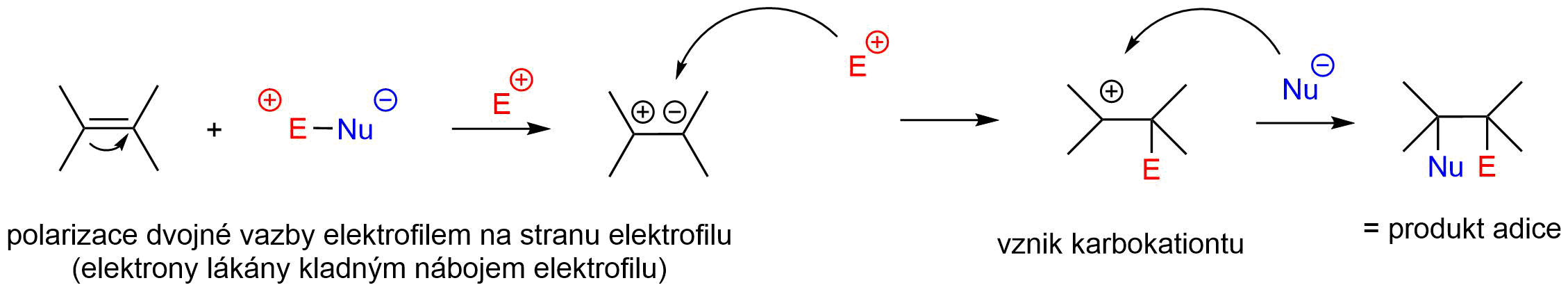
Obr. 2: Obecný mechanismus elektrofilní adice
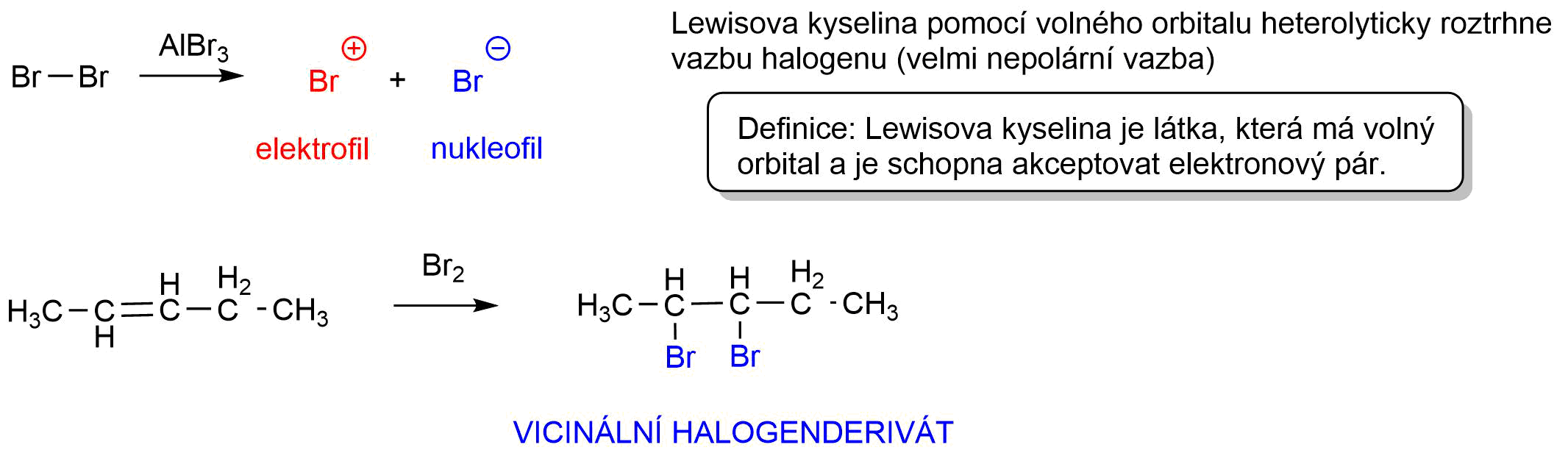
Obr. 3: Lewisova kyselina a příklad halogenace alkenu.
Mechanismus rce je podrobně popsán ve videu, nicméně je dobré si uvědomit, že vzniká karbokation, který je stabilnější. Tato skutečnost se nám bude velmi hodit hned v dalším tématu. Stabilita kationtů je ukázána na následujících obrázcích:
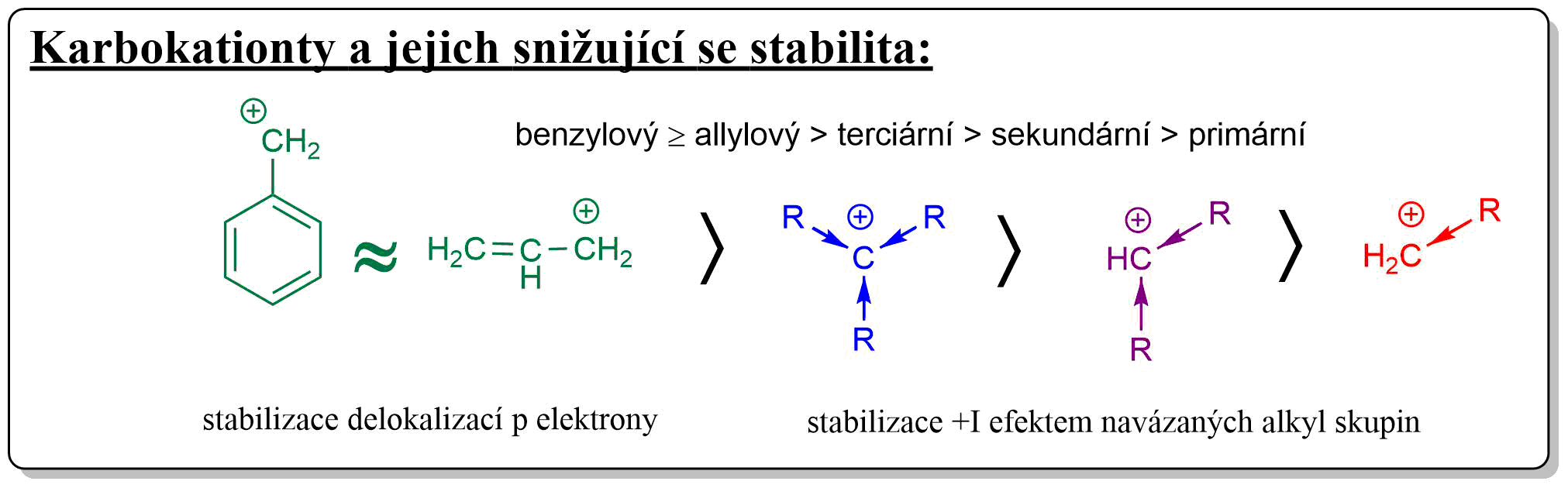
Obr. 4: Snižující se stabilita karbokationtů
Halogenaci podstupují poměrně snadno chlór a brom. Jód s většinou alkenů nereaguje a fluor je příliš reaktivní (nutno speciální podmínky). Důležitým faktem je také to, že adice halogenů probíhá při vzniku trans isomerů! V prvním kroku se kation bromný (\(Br^+\)), jako elektrofil, naváže na dvojnou vazbu za vzniku bromoniového kationtu, který se bude stabilizovat reakcí s bromidovým aniontem. Bromidový anion k bromoniovému kationtu však přistoupí z opačné strany. Zdůvodnění je takové, že bromoniový kation je stericky objemný a bromidový anion má z opačné strany snazší přístup. Tato reakce je steroselektivní.
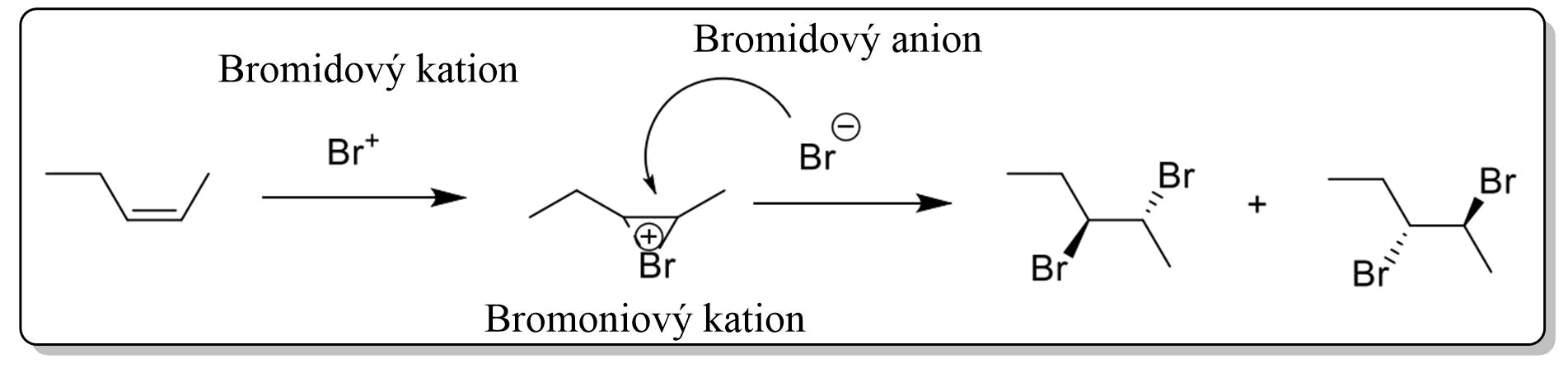
Obr. 5: Vznik trans isomerů při adici halogenu na alken