Vazebné úhly, hybridizace
Řešená cvičení
Velikost vazebných úhlů
Střední škola • 5 min
Určete v této molekule velikost všech vazebných úhlů (vizte obrázek ve videu).
Testy
-%
Vazebné úhly, hybridizace
Střední škola • 2 min
-%
Uhlíky ve skupinách -%
Podrobnosti o látce
Výpisky ke stažení
Autor videa
Jan Blahut
Lektor chemie, fyziky, matematiky a českého jazyka.
Klíčová slova
Střední škola
Odhadovaná délka studia
0 h 18 min
Poznámka k videu
Už v naší první kapitole "druhy vzorců, vaznost" jsme se zmiňovali o skutečnosti, že organický uhlík je vždy 4vazný. Následující ukázkou elektronové konfigurace uhlíku jsme definovali, aby uhlík byl 4vazný, musí být v excitovaném stavu a ve valenčních orbitalech mít po jednom elektronu.
.png)
Obrázek 1: Elektronová konfigurace uhlíku za normálního stavu a v excitovaném stavu (značený *)
Následně excitovaný uhlík může vytvářet 4 vazby s prvky, které obsahují také jeden nespárovaný elektron. Jako nejtypičtější příklad lze uvést vodík, halogen,…. Vytvoření vazeb a vznik organické molekuly s využitím elektronové konfigurace lze zjednodušeně znázornit pomocí následujícího obrázku:
.png)
Obrázek 2: Schematicky znázornění vytvoření vazeb mezi uhlíkem a vodíky. Barevně odlišené vazby vzniklé zapojením jiného uhlíkového orbitalu.
Ze schématu jednoznačně vyplývá, že uhlík tvoří 3 vazby s vodíkem pomocí orbitalů 2p2 a 1 vazbu s využitím orbitalu \(2s^2\). Na první pohled by se tato skutečnost nezdála nikterak zvláštní. Avšak při znalosti principů obecné chemie je nutné si uvědomit, že uhlík vytvořil vazby z orbitalů, které se liší svou energii. Tudíž by jedna vazba měla být odlišná od ostatních třech svou energií. Nicméně tomu tak není. Všechny vazby si jsou rovnocenné a tento stav je způsoben právě zmiňovanou hybridizací. Hybridizace způsobuje sjednocení dvou energeticky si blízkých orbitalů. Dalo by se říci, že díky hybridizaci vzniká nový orbital splynutím dvou předešlých druhů orbitalů. Důležité je říct, že se s hybridizací setkáváme nejčastěji u valenčních orbitalů. Hybridní orbitaly jsou oproti původním zcela zdeformované. Do značení hybridizace se zahrnují jak druhy orbitalů, tak jejich počet. Pokud se do „hybridu“ zformuje jeden orbital s a p – mluvíme o hybridizaci sp. U zapojení jednoho orbitalu s a dvou p – hovoříme o hybridizaci sp2. Další hybridizace se tvoří následným přidáváním dalších orbitalů.
NEJDŮLEŽITĚJŠÍ VĚCÍ JE SKUTEČNOST, ŽE HYBRIDIZACE SE TÝKÁ POUZE \(\sigma\) VAZEB. Hybridizace neslouží pouze pro sjednocení, ale také pro to, aby vazby byly pevnější.
.png)
Obrázek 3: Tvar s a p orbitalu a následný tvar vzniklý splynutím orbitalů v hybridizaci sp.
S hybridizací jsou úzce spojeny tvary molekul a vazebné úhly. Jako příklad si lze uvést methan, jenž vytváří tetraedr (neboli čtyřstěn).
.png)
Obrázek 4: Ztvárnění tetraedru (čtyřstěnu) tvořeného methanem.
Při vyjádření prostorového uspořádání na planární papír, se využívá tzv. Fischerova projekce, kdy 2 vazby jsou vyplněny plně a 2 vazby vyšrafované (čárkovaně). Toto označení se především vyskytuje u cukrů! Molekula je k nám natočena způsobem, jako by uhlík ležel na rovině papíru, vazby znázorněné plně vyčnívají vazby směřující nad rovinu papíru a dvě čárkované vazby míří pod rovinu papíru. Je nutné udržovat logickou souslednost vazeb, tudíž sousední vazby jsou jiného typu a naopak vazby ležící naproti sobě stejného!
.png)
Obrázek 5: Prostorový zápis pomocí plných a prázdných (čárkovaných) vazeb.
Lze znázornit látku i dalším způsobem, jak je popsáno na videu.
.png)
Obrázek 6: Prostorové uspořádání, kdy na planární desce leží uhlík a dva vodíky a nad a pod rovinu vystupuje po jednom vodíku.
Ohledně velikosti úhlů se uplatňují elektrony. Elektrony jsou záporně nabité a dva valenční elektrony tvoří jednu vazbu. Samozřejmě částice nabité stejnými náboji na sebe působí odpudivými silami. Jelikož atomy jsou vázány přes zmíněné elektrony, snaží se vazby (= elektrony) rozmístit do prostoru tak, aby navzájem byly co nejdále. Důležité je připomenout, že dvojné vazby odpuzují více (větší elektronová hustota). Stejné elektronové páry odpuzují také více než \(\sigma\) vazby, jelikož jsou blíže jádru. Tvary molekul, hybridizace a následně i úhly jsou znázorněny v následující tabulce VSEPR:
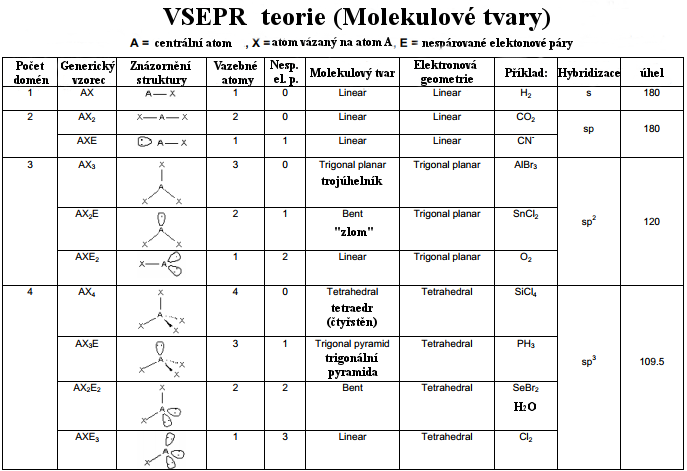
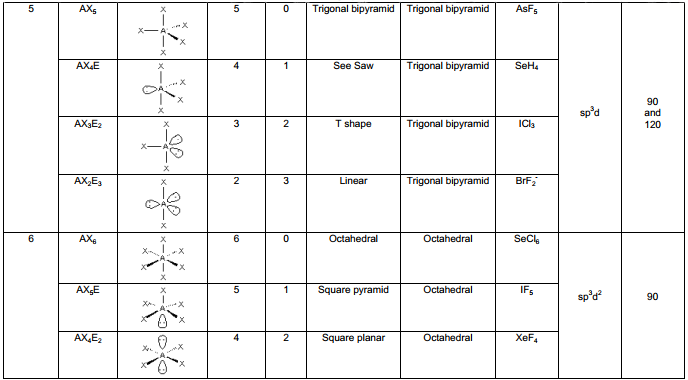
Obrázek 7: Tabulka molekulových modelů: VSEPR.